重篤な副作用チェックツール
症状確認
以下の条件に該当するかチェックしてください。
薬や医療機器を使った治療を受けているとき、医師や看護師が「重篤な副作用(Serious Adverse Event)」という言葉を使うことがあります。この言葉を聞いて、すぐに「命に関わる危険な反応だ」と思い込む人が多いです。でも、それは間違いです。FDA(米国食品医薬品局)が定める「重篤な副作用」の意味は、もっと具体的で、そして意外と日常的な状況を含んでいます。
「重篤な副作用」は、どんなときに分類されるの?
FDAは、重篤な副作用を5つの明確な基準で定めています。どれか一つでも当てはまれば、それは「重篤な副作用」として報告されます。
- 死亡:薬や治療と関係があると疑われる場合、死亡が確認されたとき
- 命の危険:その時点で、患者が死ぬ可能性が実際にあったとき(例:心停止寸前、重度の呼吸困難)
- 入院または入院期間の延長:病院に初めて入院した場合、またはすでに入院している患者が24時間以上長く入院した場合
- 障害や恒久的な損傷:日常生活が大きく崩れるほどの身体的・精神的影響(例:神経損傷で歩けなくなった、視力が永久に失われた)
- 先天性異常:妊娠中に薬を服用したことで、胎児に出生障害が生じた場合
これら以外でも、「重要医療イベント(Important Medical Events)」と呼ばれる状況があります。これは、上記の5つに当てはまらないけれど、放っておくと重篤な結果につながる可能性があるものです。たとえば、重度の不整脈が一時的に起きたが、すぐに治療で治った。これは「命の危険」にはならなかったけれど、次回は心停止になる可能性があると医師が判断すれば、重篤な副作用として報告されます。
「重篤」と「重度」は違う。この違いを知ると不安が減る
多くの患者が混乱するのは、「重篤(serious)」と「重度(severe)」の違いです。
「重度」は、症状の強さを表します。がんの臨床試験でよく使われる「CTCAE」という評価基準では、副作用の強さを1〜5段階で分けます。
- 1度(軽度):気にならない程度
- 2度(中等度):ちょっと不快だけど、日常生活に影響なし
- 3度(重度):病院での治療が必要(点滴や注射など)
- 4度(生命を脅かす):集中治療が必要
- 5度(死亡)
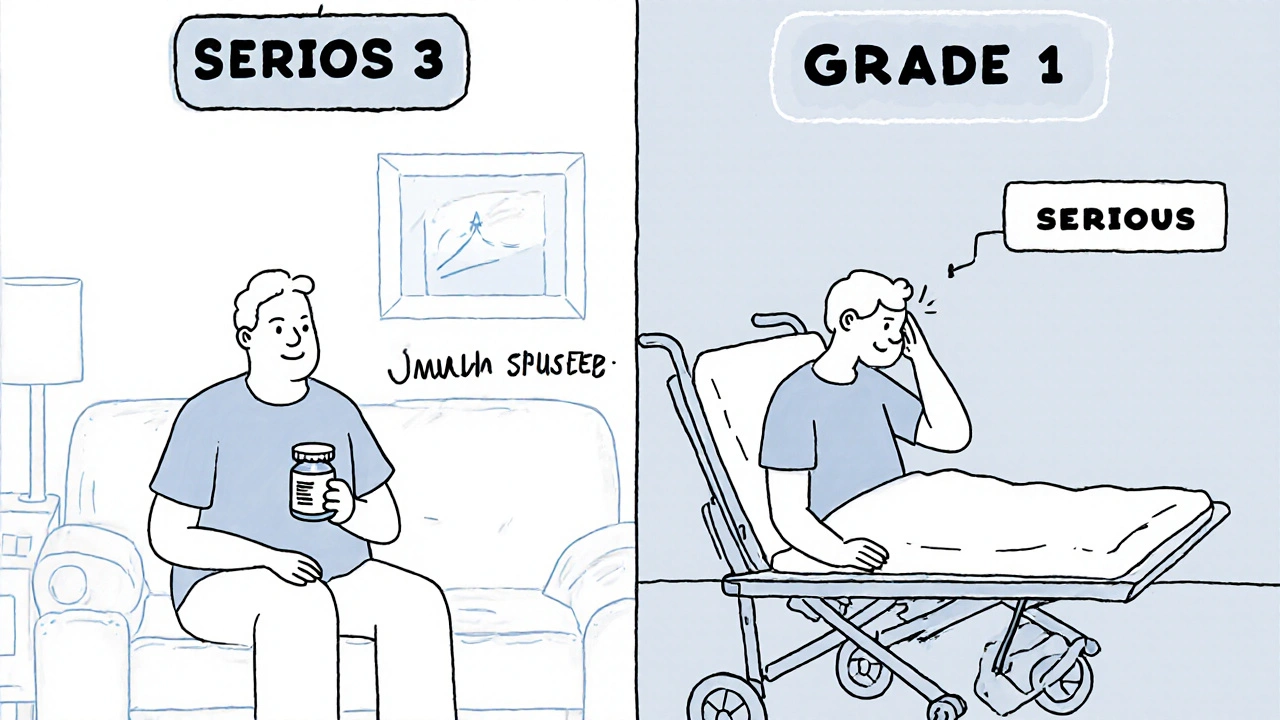
ここで重要なのは、3度(重度)の副作用でも、入院しなければ「重篤な副作用」にはならないということです。たとえば、白血球が激減して「中性球減少症(Grade 3)」と診断されたとしても、薬を一時中止して数日で回復すれば、FDAの定義では「重篤」ではありません。一方で、軽い頭痛(Grade 1)でも、それが原因で救急車で病院に運ばれたら、それは「重篤な副作用」になります。
2022年の調査では、がんの臨床試験に参加した患者の68%が、重度(Grade 3以上)の副作用を経験しましたが、そのうちの半分以上は「重篤」ではなかったと報告されています。この違いを理解していれば、不安に過剰反応する必要がありません。
患者が実際に経験した「勘違い」と「気づき」
患者コミュニティでは、この違いがもたらす影響がはっきりと表れています。
あるがん患者は、臨床試験の説明書で「Grade 4の中性球減少症」と見ると、すぐに「死ぬかもしれない」と思い込み、家族に遺書を書こうとしたそうです。しかし、看護師に「この副作用は予想されていたもので、薬を止めて抗生物質を飲めばすぐに回復する」と説明されて、ようやく安心しました。
一方で、糖尿病の臨床試験に参加した別の患者は、「糖尿病性ケトアシドーシスで入院した」と記録されているのを見て、「これは重篤な副作用だ」と理解しました。そして、次に同じ症状が出たときに「すぐに病院に行こう」と行動できました。このように、正しい知識があると、無駄な恐怖と、本当に必要な対応の両方を正しく判断できます。
臨床試験の同意書に何が書かれているか、見方を教える
臨床試験に参加するとき、必ず「インフォームド・コンセント(同意書)」に署名します。この文書の「リスクと不快感」のセクションに、重篤な副作用のリストが載っています。ここには「○○%の患者で重篤な感染症が発生」といった形で、実際に起きた副作用の割合が書かれています。
でも、この文章だけでは理解が難しいのが現実です。2022年の調査では、同意書を読んだ患者の78%が「重篤」と「重度」を混同していました。そのため、FDAは2023年から、臨床試験の同意書に「患者向け用語集」の追加を推奨しています。たとえば:
「重篤な副作用とは:死につながる、病院に入院する必要がある、体に永久的なダメージを与える、または命の危険がある状況のことです。」
このように、平易な言葉で説明された定義があれば、理解は劇的に変わります。
薬の添付文書とFDAの報告システム
市販薬の添付文書(薬の説明書)には、「注意すべき副作用」の欄があります。ここには「重篤な副作用」として報告された事例が、頻度とともに記載されています。たとえば、ある糖尿病薬の添付文書には「重篤な肝障害:0.5%」と書かれているかもしれません。
あなたが経験した副作用が、このリストに載っていなくても、報告することはできます。FDAは「MedWatch」というシステムを運営していて、患者自身が直接、副作用の報告ができます。報告書(Form 3500B)はオンラインで簡単に提出でき、2022年には38,452件の患者からの報告がありました。これは、医療機関を通さずに、あなたが医療の安全性を守る手助けになる行動です。

なぜこの分類が重要なのか?あなたの命を守る仕組み
FDAが重篤な副作用を厳密に分類するのは、単にデータを集めるためではありません。その目的は、新しい薬や治療法が、どれだけ安全かをリアルタイムで見極めることです。
2022年だけで、FDAはこのシステムのおかげで、128件の安全警告を出し、47件の薬のラベル(説明文)を変更しました。たとえば、ある高血圧薬が、少数の患者で重篤な肝障害を引き起こすことが判明。その結果、ラベルに「肝機能検査を定期的に受けてください」という注意が追加されました。これにより、多くの患者が予防的に検査を受け、命を守ることができました。
また、FDAの「Sentinelイニシアチブ」というシステムは、全米3億人分の医療記録をリアルタイムで監視しています。薬を飲んでから数日で、ある病院で同じような副作用が急に増えた場合、AIが自動で異常を検知し、すぐに調査を始めます。
今後の改善とあなたができること
2023年、FDAは「重篤な副作用の報告を、患者にとってもっとわかりやすくする」ための新しいガイドラインを発表しました。2024年には、患者専用の教育ポータルが開設される予定です。ここでは、動画やインタラクティブなツールで、重篤と重度の違いを楽しく学べるようになります。
あなたができることは、たった2つです。
- 「重篤な副作用」の定義を覚える:死亡、入院、命の危険、障害、先天異常の5つ
- 症状が起きたら、すぐに「これは重篤な副作用か?」と自問する。そして、医療チームに伝える
重篤な副作用は、怖いものではありません。それは、医療の安全性を守るための「サイン」です。正しい知識があれば、あなたは不安に振り回されず、自分自身の健康をより賢く守ることができます。






コメント
Hiroko Kanno
27 10月 2025あ、これめっちゃわかる!前に薬の説明書読んで『重篤』って聞いて、『あ、死ぬかも』ってパニックになったんだけど、看護師さんに『入院してないなら大丈夫』って言われてホッとした。言葉の違いって本当に命に関わるよね。
kimura masayuki
29 10月 2025あーもう日本は遅れてるよな!FDAの定義をちゃんと説明してる記事が日本語で出るなんて、アメリカ並みの医療リテラシーがやっと来たってことか?でもこの記事、普通の患者に届いてるのか?日本の病院の説明書は未だに『重度=重篤』で書いてるんだよ!患者が死ぬ前に、医療界がちゃんと変われよ!
雅司 太田
29 10月 2025僕の母ががんの治療中で、この記事見せてあげたんだ。『Grade 3の白血球減少』って書かれてて、『また入院?』って泣きそうになってたけど、この違いを説明したら、『あ、でも薬止めて数日で戻るんだね』って安心した。言葉の力って、本当に大きいなって改めて思った。
Hana Saku
31 10月 2025この記事、『重篤』と『重度』の違いを説明してるって言ってるけど、『入院期間の延長』って何日から?24時間って明記してないじゃん。『命の危険』ってのも曖昧。これじゃあ、患者がまた誤解するだけ。医療情報は正確に、文法的にも完璧に書くべきだ。この記事、編集ミスだらけ。
Mari Sosa
1 11月 2025日本語で『重篤』って言うと、なんか死ぬイメージしかないよね。でもアメリカの定義って、実は『医療の介入が必要』って意味なんだと気づかされた。これ、海外の患者と話すときに、絶対役立つ知識だ。日本でももっとこうした『文化翻訳』が欲しいな。
kazu G
3 11月 2025FDAの重篤な副作用の定義は、医療安全の根幹を成す客観的基準である。臨床試験における報告の標準化は、リスクベネフィット評価の信頼性を確保する上で不可欠である。患者が自己報告を行うMedWatchシステムは、監視体制の強化に寄与している。本稿の内容は、医療情報の透明性向上に貢献する。